引用本文:中国抗癌协会胃癌专业委员会, 中华医学会外科学分会胃肠外科学组, 中国医师协会外科医师分会上消化道专业委员会, 等. 腹腔镜胃癌根治术消化道重建相关并发症防治中国专家共识(2022版)[J]. 中华胃肠外科杂志, 2022, 25(8): 659-668. DOI: 10.3760/cma.j.cn441530-20220712-00302.
作者:中国抗癌协会胃癌专业委员会 中华医学会外科学分会胃肠外科学组 中国医师协会外科医师分会上消化道专业委员会 中国研究型医院学会消化道肿瘤专业委员会
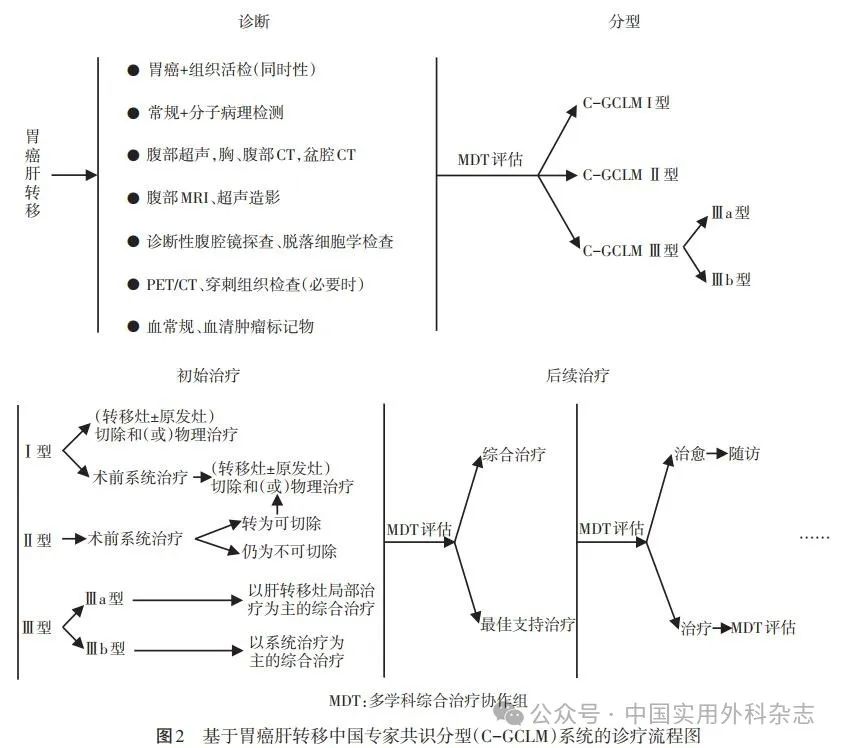
根据胃癌的肿瘤位置与分期的不同,临床上会分别选择远端胃癌根治术、根治性全胃切除术以及近端胃癌根治术等进行治疗。无论何种胃癌根治性手术方式,消化道重建都是胃癌手术的重要环节,也是并发症发生的主要部分。手术并发症的出现直接影响患者的治疗效果和术后生活质量,甚至导致死亡,产生前功尽弃的严重后果!因此,在腹腔镜手术如火如荼地开展中,如何安全地进行消化道重建以减少相关并发症的发生,以及如何妥善有效地处理并发症,将有利于整体提升我国胃癌的治疗水平。本共识主要针对消化道重建过程中和术后近期可能发生的并发症,从发生原因、预防措施和治疗措施等方面,经过查阅大量资料并结合临床实践,在反复征求国内权威专家们的意见和讨论修改后形成专家共识,为我国外科医生提高胃癌根治性切除术消化道重建并发症的防治水平提供了有效的参考。
本共识是在中国抗癌协会胃癌专业委员会、中华医学会外科学分会胃肠外科学组和中国医师协会外科医师分会上消化道专业委员会以及中国研究型医院学会消化道肿瘤专业委员会的指导和推动下,由《中华胃肠外科杂志》组织我国胃癌相关专业领域的专家,结合国内外文献和专家投票结果所达成。所指的并发症是全腹腔镜或腔镜辅助消化道重建术中(即消化道重建过程)和术后近期(术后30 d内)发生的并发症。推荐强度分强推荐和弱推荐。根据专家投票结果,支持率≥85%为强推荐,<85%为弱推荐。
编审委员会专家组成员名单(按姓氏拼音首字母排序)
主任委员:
陈凛、胡祥、季加孚、梁寒、彭俊生、徐惠绵、朱正纲
委员会成员:
陈俊强(广西医科大学附属第一医院)、陈路川(福建省肿瘤医院)、程向东(浙江省肿瘤医院)、房学东(吉林大学中日联谊医院)、韩方海(中山大学孙逸仙纪念医院)、何显力(空军军医大学附属唐都医院)、何裕隆(中山大学附属第一医院)、胡建昆(四川大学华西医院)、胡文庆(长治医学院附属长治市人民医院)、黄昌明(福建医科大学附属协和医院)、黄华(复旦大学肿瘤医院)、季刚(空军军医大学附属西京医院)、姜可伟(北京大学人民医院)、李初俊(中山大学附属第六医院)、李国立(南京东部战区总医院)、李国新(南方医科大学南方医院)、李乐平(山东省立医院)、李太原(南昌大学附属第一医院)、李勇(广东省人民医院)、李子禹(北京大学肿瘤医院)、练磊(中山大学附属第六医院)、梁品(大连医科大学附属第一医院)、刘凤林(复旦大学附属中山医院)、孙益红(复旦大学附属中山医院)、陶凯雄(华中科技大学附属协和医院)、田艳涛(中国科学院肿瘤医院)、王琛(兰州大学第二医院)、王海江(新疆医科大学附属肿瘤医院)、王磊(宁夏医科大学附属第一医院)、王权(吉林大学附属第一医院)、王振宁(中国医科大学附属第一医院)、卫勃(解放军总医院)、卫洪波(中山大学附属第三医院)、徐泽宽(南京医科大学附属第一医院)、薛英威(哈尔滨医科大学附属肿瘤医院)、燕速(青海大学附属第一医院)、杨祖立(中山大学附属第六医院)、余江(南方医科大学南方医院)、于健春(北京协和医院)、臧潞(上海交通大学医学院附属瑞金医院)、张波(中山大学附属第六医院)、张成武(青海大学附属第一医院)、赵群(河北医科大学附属第四医院)、郑志超(辽宁省肿瘤医院)、周岩冰(青岛大学附属医院)、周志伟(中山大学附属肿瘤医院)
撰稿组成员:
中山大学附属第六医院胃外科团队(练磊、陈实、陈永和、王华摄、林义佳、王新友)
执笔统筹:
彭俊生(中山大学附属第六医院)
[2] Zhang S, Sun K, Zheng R, et al. Cancer incidence and mortality in China, 2015 [J]. Journal of the National Cancer Center, 2021,1(1):2-11.DOI:10.1016/j.jncc.2020. 12.001.
[3] 苗儒林, 李子禹, 武爱文. 中国胃肠肿瘤外科联盟数据报告(2014-2016) [J]. 中国实用外科杂志, 2018, 38(1):90-93.DOI: 10.19538/j.cjps.issn1005-2208.2018.01.20.
[4] Yu J, Huang C, Sun Y, et al. Effect of laparoscopic vs open distal gastrectomy on 3-year disease-free survival in patients with locally advanced gastric cancer: the CLASS-01 randomized clinical trial [J]. JAMA, 2019, 321(20): 1983-1992. DOI:10.1001/jama. 2019.5359.
[5] Kim HH, Han SU, Kim MC, et al. Effect of laparoscopic distal gastrectomy vs open distal gastrectomy on long- term survival among patients with stage I gastric cancer: the KLASS-01 randomized clinical trial[J]. JAMA Oncol, 2019,5(4):506-513. DOI:10.1001/jamaoncol.2018.6727.
[6] Hyung WJ, Yang HK, Park YK, et al. Long-term outcomes of laparoscopic distal gastrectomy for Locally advanced gastric cancer: the KLASS-02-RCT randomized clinical trial[J]. J Clin Oncol, 2020,38(28):3304-3313.DOI:10. 1200/jco.20.01210.
[7] Katai H, Mizusawa J, Katayama H, et al. Survival outcomes after laparoscopy-assisted distal gastrectomy versus open distal gastrectomy with nodal dissection for clinical stage IA or IB gastric cancer (JCOG0912): a multicentre, non-inferiority, phase 3 randomised controlled trial [J]. Lancet Gastroenterol Hepatol, 2020, 5(2):142-151.DOI: 10.1016/s2468-1253(19) 30332-2.
[8] Zeng YK, Yang ZL, Peng JS, et al. Laparoscopy-assisted versus open distal gastrectomy for early gastric cancer: evidence from randomized and nonrandomized clinical trials [J]. Ann Surg, 2012,256(1):39-52.DOI:10.1097/SLA. 0b013e3182583e2e.
[9] Jung DH, Ahn SH, Park DJ, et al. Proximal gastrectomy for gastric cancer [J]. J Gastric Cancer, 2015,15(2):77-86. DOI: 10.5230/jgc.2015.15.2.77.
[10] Ahn SH, Jung DH, Son SY, et al. Laparoscopic double-tract proximal gastrectomy for proximal early gastric cancer [J]. Gastric Cancer, 2014, 17(3):562-570.DOI: 10.1007/s10120-013-0303-5.
[11] 程向东, 张延强, 徐志远, 等. 食管-胃"程氏Giraffe重建术"在食管胃结合部腺癌近端胃切除后消化道重建患者中应用的初步疗效分析[J]. 中华胃肠外科杂志, 2020,23(2):158-162.DOI: 10.3760/cma.j.issn.1671-0274.2020.02.011.
[12] 卫洪波, 魏波. 全胃切除术后消化道重建术式的再探讨 [J]. 中华胃肠外科杂志, 2014, 17(5):411-415.DOI: 10.3760/cma.j.issn.1671-0274.2014.05.001.
[13] 邹镇洪, 牟廷裕, 邓镇威, 等. 完全腹腔镜全胃切除胃癌根治术消化道重建方式的探讨[J]. 中华胃肠外科杂志, 2014, 17(8):844-847. DOI:10.3760/cma.j.issn.1671-0274.2014. 08.031.
[14] 近端胃切除消化道重建中国专家共识编写委员会. 近端胃切除消化道重建中国专家共识(2020版) [J]. 中华胃肠外科杂志, 2020,23(2):101-108.DOI: 10.3760/cma.j.issn.1671- 0274.2020.02.002.
[15] 黄昌明,郑朝辉,陆俊.完全腹腔镜胃癌手术消化道重建专家共识及手术操作指南(2018版)[J].中国实用外科杂志,2018,38(8):833-839.DOI:10.19538/j.cjps.issn1005- 2208. 2018.08.01.
[16] 中国腹腔镜胃肠外科研究组(CLASS研究组), 中华医学会外科学分会腹腔镜与内镜外科学组,中华医学会外科学分会胃肠外科学组. 腹腔镜胃癌手术患者使用口服营养补充的专家共识(2020版) [J]. 中华胃肠外科杂志, 2020, 23(7):623-628.DOI:10.3760/cma.j.cn.441530-20200604- 00342.
[17] 孙益红, 方勇. 胃癌根治术后吻合口相关并发症的发生原因及防治要点 [J]. 中华胃肠外科杂志, 2017,20(2):144- 147.DOI:10.3760/cma.j.issn.1671-0274.2017.02.006.
[18] Chan SM, Auyeung KKY, Lam SF, et al. Current status in endoscopic management of upper gastrointestinal perforations, leaks and fistulas [J]. Dig Endosc, 2022, 34(1):43-62. DOI:10.1111/den.14061.
[19] 张鹏, 陶凯雄. 胃癌术后吻合口漏的预防与处理 [J]. 中国普外基础与临床杂志, 2021, 28(6):717-720.DOI: 10.7507/1007-9424.202104078.
[20] Hoeppner J, Kulemann B, Seifert G, et al. Covered self-expanding stent treatment for anastomotic leakage: outcomes in esophagogastric and esophagojejunal anastomoses [J]. Surg Endosc, 2014,28(5):1703-1711.DOI: 10.1007/s00464-013-3379-4.
[21] Hallit R, Calmels M, Chaput U, et al. Endoscopic management of anastomotic leak after esophageal or gastric resection for malignancy: a multicenter experience [J]. Therap Adv Gastroenterol, 2021,14:175628 48211032823. DOI:10.1177/17562848211032823.
[22] Kuroda S, Choda Y, Otsuka S, et al. Multicenter RETrospective study to evaluate the efficacy and safety of the double-flap technique as antireflux esophagogastrostomy after proximal gastrectomy (rD-FLAP Study) [J]. Ann Gastroenterol Surg, 2019,3(1):96-103. DOI:10.1002/ags3.12216.
[23] Aihara R, Mochiki E, Ohno T, et al. Laparoscopy-assisted proximal gastrectomy with gastric tube reconstruction for early gastric cancer [J]. Surg Endosc, 2010, 24(9):2343-2348. DOI: 10.1007/s00464-010-0947-8.
[24] Hori S, Ochiai T, Gunji Y, et al. A prospective randomized trial of hand-sutured versus mechanically stapled anastomoses for gastroduodenostomy after distal gastrectomy [J]. Gastric Cancer, 2004, 7(1):24-30.DOI: 10.1007/s10120-003-0263-2.
[25] Park DJ, Lee HJ, Kim HH, et al. Predictors of operative morbidity and mortality in gastric cancer surgery [J]. Br J Surg, 2005, 92(9):1099-1102.DOI: 10.1002/bjs.4952.
[26] Li TF, Wu G, Han XW, et al. Application of y-shaped, coated self-expandable metallic stents for anastomotic stenosis after gastrojejunostomy (Billroth II) [J]. Acta Radiol, 2017, 58(1):41-45. DOI:10.1177/0284185116633909.
[27] Jin T, Liu HD, Chen ZH, et al. Linear stapler versus circular stapler for patients undergoing anastomosis for laparoscopic gastric surgery: a meta-analysis[J]. J Invest Surg, 2022:1-11.DOI: 10.1080/08941939.2022.2058126.
[28] Nomura E, Kayano H, Seki T, et al. Preventive procedure for stenosis after esophagojejunostomy using a circular stapler and transorally inserted anvil (OrVil™) following laparoscopic proximal gastrectomy and total gastrectomy involving reduction of anastomotic tension [J]. BMC Surg, 2021, 21(1):47.DOI: 10.1186/s12893-021-01054-0.
[29] Fukagawa T, Gotoda T, Oda I, et al. Stenosis of esophago- jejuno anastomosis after gastric surgery [J]. World J Surg, 2010,34(8):1859-1863.DOI: 10.1007/s00268-010- 0609-y.
[30] 彭俊生, 陈实. 腹腔镜胃癌根治术消化道重建相关并发症的防治[J]. 中华胃肠外科杂志, 2017, 20(2):156-159.DOI: 10.3760/cma.j.issn.1671-0274.2017.02.009.
[31] Yamashita Y, Yamamoto A, Tamamori Y, et al. Side overlap esophagogastrostomy to prevent reflux after proximal gastrectomy [J]. Gastric Cancer, 2017, 20(4):728-735.DOI: 10.1007/s10120-016-0674-5.
[32] 郑建伟, 蔡淑艳. 胃手术后输入袢急性梗阻的诊断及手术方式 [J]. 中国普外基础与临床杂志, 2014, 21(7):883-885.DOI: 10.7507/1007-9424.20140210.
[33] Arima J, Taniguchi K, Kobayashi T, et al. Systemic steroid application for treatment of edematous anastomotic stenosis following delta-shaped anastomosis in laparoscopic distal gastrectomy: a case report [J]. BMC Surg, 2020,20(1):163.DOI: 10.1186/s12893-020-00827-3.
[34] Irani S, Jalaj S, Ross A, et al. Use of a lumen-apposing metal stent to treat GI strictures (with videos) [J]. Gastrointest Endosc, 2017,85(6):1285-1289.DOI: 10.1016/ j.gie.2016.08. 028.
[35] 汪建平,詹文华. 胃肠外科手术学 [M]. 北京:人民卫生出版社, 2006.
[36] Pereira-Lima JC, Lemos Bonotto M, Hahn GD, et al. A prospective randomized trial of intralesional triamcinolone injections after endoscopic dilation for complex esophagogastric anastomotic strictures: steroid injection after endoscopic dilation [J]. Surg Endosc, 2015,29(5):1156-1160. DOI:10.1007/s00464-014-3781-6.
[37] Muto M, Ezoe Y, Yano T, et al. Usefulness of endoscopic radial incision and cutting method for refractory esophagogastric anastomotic stricture (with video) [J]. Gastrointest Endosc, 2012, 75(5):965-972.DOI: 10.1016/j.gie.2012.01.012.
[38] Lee S, Ahn J Y, Na S, et al. Clinical features of postoperative anastomotic bleeding after gastrectomy and efficacy of endoscopic hemostasis: a case-control study [J]. Surg Endosc, 2017,31(8):3210-3218.DOI:10.1007/s00464- 016-5347-2.
[39] 李子禹, 吴舟桥. 胃癌术后出血的预防及处理[J]. 中国普外基础与临床杂志, 2021, 28(6):704-707.DOI: 10.7507/1007-9424.202104020.
[40] Chen S, Chen XJ, Chen DW, et al. A novel anti-reflux reconstruction after laparoscopic total gastrectomy: jejunal pouch-esophageal anti-reflux anastomosis [J]. Gastroenterol Rep (Oxf), 2018,6(3):234-238.DOI: 10.1093/ gastro/goy019.
[41] 国际食管疾病学会中国分会(CSDE)食管胃结合部疾病跨界联盟, 中国医师协会内镜医师分会腹腔镜外科专业委员会, 中国医师协会外科医师分会上消化道外科医师专业委员会,等. 食管胃结合部腺癌外科治疗中国专家共识(2018年版) [J]. 中华胃肠外科杂志, 2018, 21(9):961-975.DOI: 10.3760/cma.j.issn. 1671-0274.2018. 09.001.
[42] 中国抗癌协会胃癌专业委员会. 局部进展期胃癌围手术期治疗中国专家共识(2021版) [J]. 中华胃肠外科杂志, 2021, 24(9):741-748.DOI: 10.3760/cma.j.cn.441530-2021 0831- 00351.
[43] Miyagaki H, Takiguchi S, Kurokawa Y, et al. Recent trend of internal hernia occurrence after gastrectomy for gastric cancer [J]. World J Surg, 2012, 36(4):851-857.DOI: 10. 1007/s00268-012-1479-2.
[44] Kang KM, Cho YS, Min SH, et al. Internal hernia after gastrectomy for gastric cancer in minimally invasive surgery era [J]. Gastric Cancer, 2019, 22(5):1009-1015.DOI: 10.1007/s10120-019-00931-1.
[45] 刘颂, 陆晓峰, 缪骥, 等. 胃癌切除术后Petersen疝的临床诊疗特征 [J]. 中华胃肠外科杂志, 2020,23(12):1182-1186.DOI: 10.3760/cma.j.cn.441530-20200104-00005.
[46] Sun KK, Wu YY. Current status of internal hernia after gastrectomy for gastric cancer [J]. Langenbecks Arch Surg, 2022,407(1):99-104.DOI: 10.1007/s00423-021- 02371-x.
[47] Kojima K, Inokuchi M, Kato K, et al. Petersen's hernia after laparoscopic distal gastrectomy with Roux-en-Y reconstruction for gastric cancer [J]. Gastric Cancer, 2014, 17(1):146-151.DOI: 10.1007/s10120-013-0256-8.
[48] Liu S, Hu Q, Song P, et al. Risk Factor and surgical outcome of petersen's hernia after gastrectomy in gastric cancer [J]. Front Oncol, 2021, 11:765509.DOI:10.3389/fonc. 2021.765509.
[49] Pan T, Wang H, Liu K, et al. Closure of Petersen's defect in gastrectomy for gastric cancer: an interrupted time series analysis from a high-volume institution in China [J]. Langenbecks Arch Surg, 2021, 406(2):427-436.DOI:10. 1007/s00423-020-02019-2.